Oksidasi menjelaskan mengenai pelepasan elektron oleh sebuah molekul, atom, atau ion.
1. Oksidasi Bayer-Viliger
Oksidasi Bayer-Viliger merupakan reaksi perubahan keton menjadi ester oleh oksidasi asam peroksi atau peroksida sebagai oksidan. Pada langkah pertama dari mekanisme reaksi, asam peroksi memprotersi oksigen dari gugus karbonil. Hal ini membuat gugus karbonil lebih rentan diserang oleh asam peroksi. Selanjutnya asam peroksi menyerang karbon dari gugus karbonil membentuk zat antara Criegee. Melalui mekanisme terpadu, salah satu substituen pada keton bertpindah ke oksigen dari kelompok peroksida sementara asam karboksilat pergi. Langkah migrasi ini dianggap sebagai langkah penentuan laju. Akhirnya, deprotonasi ion oksokarbenium menghasilkan ester. Produk dari oksidasi Bayer-Viliger diyakini dikendalikan oleh efek stereoelektronik primer dan skunder.
2. Reaksi Oksidasi Jones
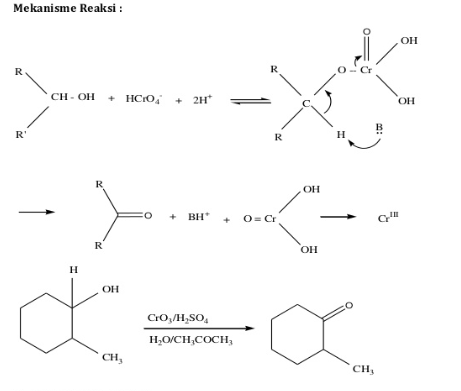
Oksidasi Jones adalah reaksi kimia dijabarkan sebagai oksidasi asam kromat untuk mengoksidasi aldehid dan keton. Oksidasi Jones adalah reaksi organik untuk oksidasi alkohol primer dan sekunder untuk menjadi asam karboksilat dan keton. Kecenderungan asam kromat untuk menyerang ikatan karbon sekunder khususnya ikatan karbon tersier merupakan dasar untuk penetapan khun-Roth perihal sejumlah gugus metal dalam suatu molekul.
Reaksi alkohol dengan larutan asam kromat berair dalam aseton membentuk ester kromat yang seimbang dan kemudian senyawa Cr (IV) dieliminasi sehingga diperoleh keton. Senyawa Cr (IV) diubah menjadi Cr(III) yang stabil melalui sderetan reaksi cepat lainnya.
Pereaksi Jones terdiri dari kromium trioksida dan asam sulfat yang dilarutkan dalam campuran aseton dan air. Sebagai alternatif, kalium dikromat dapat digunakan sebagai pengganti kromium trioksida. Oksidasi sangat cepat, cukup eksoterm, dan hasilnya biasanya tinggi. Reagen jarang mengoksidasi ikatan tak jenuh.
3. Oksidasi Pfritzer-Moffat
Oksidasi Pfritzer-Moffat adalah cara oksidasi yang umumnya berguna dan dilakukan dengan cara menambahkan alkohol dengan larutan disikloheksil karbodiimida (DCC) dan pridinium trifluoroasetat dalam dimetil sulfoksida. Kadang-kadang digunakan asam fosfat sebagai ganti piridinium triofluoro asetat, kemudian ditambahkan ke pelarut yang inert seperti benzene atau 1,2- di-metoksi enata (DME)memberikan hasil yang lebih baik.
Oksidasi ini banyak dignakan pada alkohol primer menjadi aldehid, tanpa terjadi oksidasi selanjutnya sehingga terbentuk asam karboksilat.
a. oksidasi alkohol
oksidasi alkohol adalah reaksi organik yang penting. alkohol primer (R-CH2-H) dapat dioksidasi menjadi aldehida (R-CHO) atau menjadi asam karboksilat (R-CO2H), sedangkan oksidasi alkohol sekunder biasanya berakhir pada tahap keton. Alkohol tersier tahan terhadap oksidasi.
- Reaksi Oksidasi Alkohol Primer
Oksidasi tidak langsung dari alkohol primer menjadi asam karboksilat, biasanya berlangsung melalui aldehida yang sesuai, yang diubah melalui aldehida hidrat dengan air. Oksidasi alkohol primer pada tingkat aldehida dimungkinkan dengan melakukan reaksi dengan tidak adanya air, sehingga tidak asa hidrat aldehida yang dapat terbentuk. Dalam oksidasi ini akan dihasilakan alkanal atau aldehida, reaksi ini tidak hanya bersenti sampai disitu, tetpi jika dibiarkan beberapa waktu akan menghasilkan asam karboksilat.

- Reaksi oksidasi alkohol Sekunder
pada alkoholsekunder ini ketika dioksidasi akan menghasilkan keton dan tidak akan bereaksi berkelanjutan seperti alkohol primer. perubahan pada kondisi rekasi tidak akan merubah peroduk yang telah terbentuk.
- Reaksi Oksidasi Alkohol Tersier
Alkohol tersier tahan terhadap oksidasi. alkohol tersier tidak dapat dioksidasi oleh natrium atau kalium dikromat. bahkan tidak ada reaksi yang terjadi. Alkohol tidak mempunyai sebuat atom hidrogen yang terikat pada atom karbon tersebut. sehingga perlu melepaskan kedua atom hidrogen tersebut untuk membentuk ikatan phi atau ikatan rangkap C=O.
b. Oksidasi alkena
oksidasi alkena meruakan reaksi oksidasi oksidatif yang mana akan terjadi pemutusan ikatan rangkap C=C. dibawah ini adalah beberapa contoh reaksi oksidasi alkena dengan KMnO4 dalam suhu tinggi.

reaksi pada alkeni ini terjadi dalam dua tahapan, pada tahap pertama akan teroksidasi menjadi diol yang kemudian pada tahap kedua produk akhirnya adalah asam karboksilat dan keton.

c. okidasi
permasalahan :
1. kenapa alkohol tersier tahan terhadap oksidasi ?
2. kenapa oksidasi alkohol primer menjadi asam karboksilat merupakan oksidasi tidak langsung ?
3. bagaimana jika oksidasi pada alkena dengan menggunakan KMnO4 pada suhu rendah?