baiklah jika sebelumnya saya membahas tentang pembentukan dan sifat-sifat asam karboksilat. Maka kali ini saya akan membhas turunan dari asam karboksilat.
Gugus karboksil (disingkat -CO2H atau COOH) adalah salah satu gugus fungsi yang paling banyak terjadi dalam bisang kimia. Kelompok Karboksil dari keluarga besar senyawa terkait yang disebut senyawa asil atau Turunan Asam Karboksilat. Derivat asam karboksilat yaitu senyawa yang menghasilkan asam karboksilat jika direaksikan dengan air.
Kereaktifan Asam Karboksilat
Produksi turunan asam karboksilat adalah reaksi dua langkah, yang masing-masing penting dalam memprediksi reaktivitas senyawa. Selain itu, faktor elektronik dan sterik juga penting untuk dipertimbangkan ketika membandingkan reaktivasi asam karboksilat dan turunannya.
Faktor sterik merupakan pertimbangan penting untuk menilai reaktivitas karena keberadaan kelompok besar secara signifikan mempengaruhi laju langkah pertama dalam produksi turunan; semakin besar gugus alkil yang melekat pada karbon karbonil, semakin sulit bagi nukleofil untuk menyerang karbon karbonil.
Polarisasi senyawa asil juga penting dalam memprediksi reaktivitas. Senyawa asil yang terpolarisasi lebih kuat bereaksi lebih mudah daripada yang kurang polar. Ini berarti, misalnya, asil klorida akan bereaksi lebih cepat dalam substitusi nukleofilik dibandingkan dengan amida yang kurang terpolarisasi.
Semua reaksi dan senyawa yang dibahas dalam bagian ini akan menghasilkan asam karboksilat pada hidrolisis dan dengan demikian dikenal dengan derivatif asam karboksilat. Hidrolisis adalah salah satu contoh substitusi asil nukleofilik, yang merupakan mekanisme dua langkah yang sangat penting yang umum dalam semua reaksi yang akan dibahas.
kelompok senyawa ini juga mengandung gugus karbonil, tetapi sekarang ada atom elektronegatif (oksigen, nitrogen, atau halogen) yang melekat pada karbon karbonil. perbedaan struktur ini meyebabkan perubahan besar dalam reaktivitas.
untuk gugus-gugus fungsional ini, gugus karbonil dulunya merupakan bagian dari asam karboksilat, dan untuk alasan itu, mereka dianggap sebagai turunan dari asam karboksilat.
1. asam klorida
asam klorida dibuat dari asam yang sesuai dengan reaksi thionyl chloride atau fosfor pentachloride. asam klorisa adalah yang paling reaktif dari turunan asam karboksilat. gugus asil yang terikat pada halogen disebut asil halida, yang paling umum adalah asam klorida. nama ini dibangun dengan mengidentifikasiasam karboksil ic dan mengubah akhiran menjadi -yl halida. Dengan demikian, asam propano ic akan menjadi propano yl chloride.
2. asam anhidrida
anhidrida asam tidak dapat dibentuk langsung dari asam karboksilat, tapi harus dibuat dari turunan asam karboksilat yang paling reaktif. ada dua cara dalampembuatan anhidrida, yang pertama menggunakan asam klorida dan suatu karboksilat.
dua gugus asil yang terikat pada atom oksigen yang umum adalah anhidrida karboksilat. kelompok fungsional asam anhidrida terjadi ketika dua asam karboksilat bergabung dan kehilangan air (anhidrida = tanpa air). anhidrida asam simetris diberi nama sepertiasam karboksilat kecuali asam asid akhir diganti dengan -anhidrida.
- anhridrida simetrisanhidrida simetris adalah anhidrida asam karboksilat yang memiliki rumus struktur umum berikut ini :
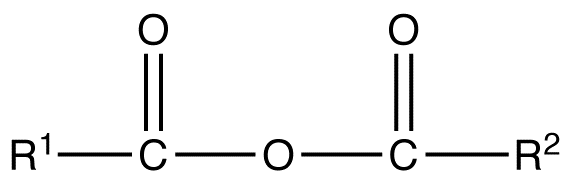 dimana R1 = R2 = atom hidrogen, gugus alkil, gugus aril
dimana R1 = R2 = atom hidrogen, gugus alkil, gugus aril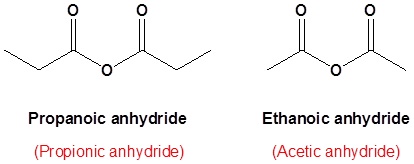
- anhidrida tidak simetrisanhidrida campuran atau tidak simetris adalah anhidrida asam karboksilat yang memiliki rumus strukturumum berikut
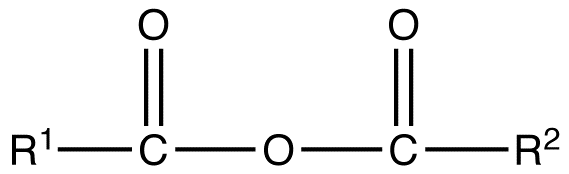 dimana R1 ≠ R2, tetapi merupakan atom hidroge, gugus alkil, gugus aril. saat menamai anhidrida asam tidak simetris, beri nama keduanya menggunakan metode umum alkanoic dan kemudian masukkan kedua namatersebut secara alfabe. oleh karena itu, nama pertama setiap komponen dan disusun menurut abjad diikuti dengan spasi dan kemudian anhidrida.
dimana R1 ≠ R2, tetapi merupakan atom hidroge, gugus alkil, gugus aril. saat menamai anhidrida asam tidak simetris, beri nama keduanya menggunakan metode umum alkanoic dan kemudian masukkan kedua namatersebut secara alfabe. oleh karena itu, nama pertama setiap komponen dan disusun menurut abjad diikuti dengan spasi dan kemudian anhidrida.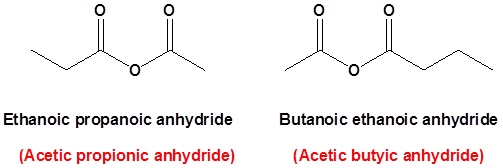
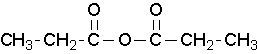 anhidrida propanoat
anhidrida propanoat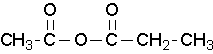 anhidrida propanoat etanoat
anhidrida propanoat etanoat
3. ester
ketika guguskarboksil terikat pada -OR atau -OAr, gugus fungsional disebut ester karboksilat atau hanya ester.
ester dibuat dari asam karboksilat dan alkohol dengan bantuan katalis yang disebut reaksi esterifikasi
ester dinamai seolah-olah rantai alkil dari alkoholadalah substituen. tidak ada nomor yang ditetapkan untuk rantai alkil ini.
4. amida
penamaan pada amida ini yaitu kata asam dihilangkan dan akhiran -oat diganti dengan amida. pada atom N tersubstitusi oleh gugus alkil, maka substituen alkil ditunjukkan dengan memberi awalan N dimana alkil tersebut terikat. Amina sangat kuat/tahan terhadap hidrolisis. tetapi dengan adanya asam atau basa pekat, hidrolisis dapat terjadi untuk menghasilkan asam klorida.
permasalahan :
1. apa yang menyebabkan asam klorida merupakan turunan dari asam karboksilat yang palimg reaktif?
2. kenapa asam anhidrida tidak dapat langsung dibuat dari asam karboksilat?
3. apa yang menyebabkan amida dapat dihidrolisis membentuk asam klorida?